兽药临床研究
一、概述
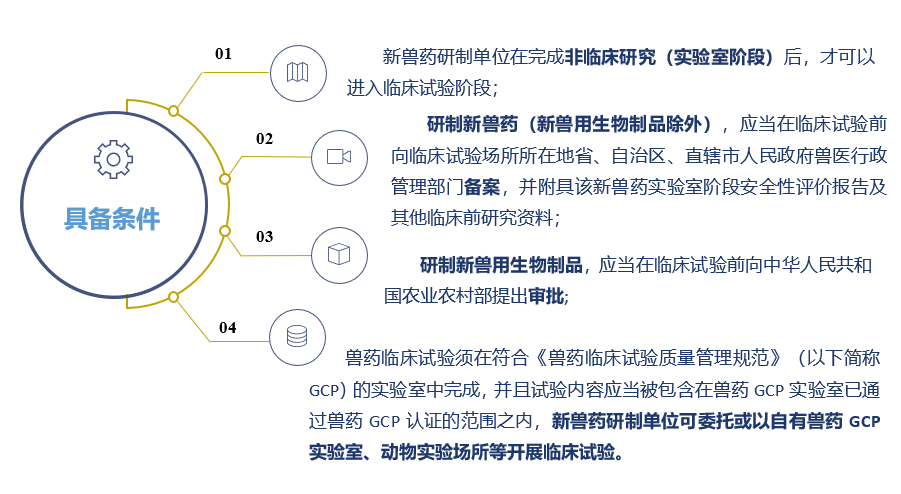
根据《兽药管理条例》、《新兽药研制管理办法》和《兽药注册办法》,新兽药研制单位在完成非临床研究后,即可进入临床试验阶段,新兽药研制单位应当在临床试验前向临床试验场所所在地省、自治区、直辖市人民政府兽医行政管理部门备案,并附具该新兽药实验室阶段安全性评价报告及其他临床前研究资料。
此阶段主要确定新兽药是否有进一步研发的意义,一般要用靶动物进行试验,可以分三期来进行。
Ⅰ期临床(实验室)试验:在实验室可控条件下进行,包括靶动物耐受性试验,寻找有效剂量和中毒剂量范围,确定靶动物的有效性和安全性;开展靶动物的药代动力学及生物利用度试验,为下一步推荐临床使用剂量提供依据;
Ⅱ期临床(实验室)试验:包括药效评价试验(随机对照治疗试验),即用健康靶动物在可控条件下进行药效对照试验,必要时进行疾病动物药代动力学试验,确定初步的有效剂量,因此也有人称为剂量确定实验。根据确定的有效剂量,在健康动物进行残留消除试验,确定使用后的休药期;
Ⅲ期临床试验国外也叫剂量验证试验,主要是验证Ⅰ、Ⅱ期的结果是否可行,此试验就是在自然生产条件下,在指定的区域进行靶动物随机对照试验,以进一步验证临床试验剂量(又称为剂量确证试验),同时根据临床使用剂量,进行靶动物的安全试验,考察加大临床使用剂量的毒副反应。
二、兽药临床试验开展需要具备哪些条件?
三、兽药临床试验开展有哪些基本流程?
1. 申请人与兽药临床试验机构沟通,确定试验项目及费用,签订合同。
2. 申请人向临床试验场所所在地省、自治区、直辖市人民政府兽医行政管理部门备案,拿到《新兽药临床试验备案表》;研制新兽用生物制品,申请人应当在临床试验前向中华人民共和国农业农村部提出审批,拿到《新兽药临床试验审批表》。
3. 申请人向临床试验机构提供临床研究前研究资料、临床试验方案、试验用兽药及检测报告、《新兽药临床试验备案表》。
4. 兽药临床试验机构开展临床试验、撰写报告。
四、兽药临床研究涉及的试验有哪些?
| Ⅰ期临床试验:观察靶动物对于新药的耐受程度和药代动力学,测定可以耐受的剂量范围,明确按照推荐的给药途径、给药适宜的安全范围和不能耐受的临床症状,为制定给药方案提供依据。 | |
| 靶动物耐受性试验 (靶动物安全性试验) | 指在推荐剂量或超过推荐剂量的应用条件下,评价受试药物对靶动物的安全性。目的是了解受试药物对靶动物的主要不良反应和生产性能的影响,从而提出受试药物的不良反应和应用时的注意事项或预防措施。 |
| 靶动物药代动力学试验 | 通过研究药物在靶动物体内的吸收、分布、代谢和排泄的规律,对药物在动物体内随时间变化而发生的量变规律进行测定,通过试验获取新兽药在靶动物的药动学参数。 |
| Ⅱ期临床(实验室)试验:初步评价兽药对靶动物目标适应症的防治作用和安全性,确定合理的给药剂量方案。 | |
| 药效评价试验 | 初步评价兽药对靶动物目标适应症的防治作用和安全性,确定合理的给药剂量方案。此阶段的研究设计可以根据具体的研究目的,采用人工发病模型或自然病例,进行随机对照临床试验。 |
| 剂量确定试验 | |
| Ⅲ期临床试验:进一步验证兽药对靶动物目标适应症的防治作用和安全性,评价利益与风险关系,最终为首要注册申请获得批准提供充分的依据。 | |
| 药效评价田间试验 | 进一步验证兽药对靶动物目标适应症的防治作用和安全性,评价利益与风险关系,最终为兽药注册申请获得批准提供充分的依据。试验应为具有足够样本量的随机盲法对照试验。 |
| 剂量确认试验 | |
| 生物等效性试验:替代Ⅱ期、Ⅲ期临床试验,仿制药应进行生物等效性试验。生物等效性试验指利用生物利用度研究的方法,以药代动力学参数为指标,比较同一种药物的相同或者不同剂型、在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异。 | |
| 残留消除试验:申请注册用于食用动物的兽药,还应当进行残留消除试验。残留消除试验指通过食用动物用药物残留消除试验获取受试药物在可食性组织中是否产生残留,并为制定合理的休药期提供理论和实践依据。 | |
五、兽药临床研究有哪些影响因素?
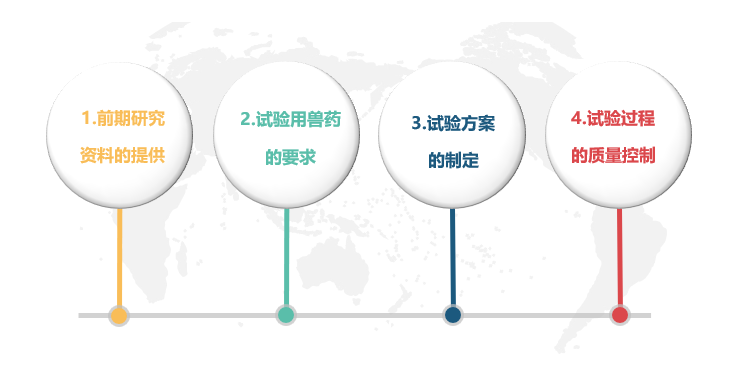
1. 前期研究资料的提供:申请人往往不能提供一套完整的前期研究资料,致使兽药临床试验机构对受试兽药的功能、主治不好定位,难以确定试验方案,也无法保证获得满意的试验结果。
2. 试验用兽药的要求:试验用兽药包括受试兽药和对照兽药。受试兽药应与拟上市的制剂完全一致,来源于同一批号,由申报单位自行研制且在GMP验收合格的车间生产,具备中监所或农业部认定的其他兽药检验机构出具的产品检验合格报告,且为“中试产品”,避免出现生产批号与第三方检测报告上的批号不一致;说明书与前期研究的给药途径、剂量等不符;有效期短于试验期限等问题。对照兽药应为“已上市产品”,与受试药物作用相似、适应证相同的药物。由申报单位提供,并提供中监所或农业部认定的其他兽药检验机构出具的产品检验合格报告,避免出现在剂型、性状上与受试兽药差异较大,造成设盲过程繁琐。
3. 试验方案的制定:造模方法选择不当或造模剂量过低,难以造出目标病证,造模剂量过高使动物死亡率过高,难以评价兽药的疗效;病例的诊断标准、纳入标准、剔除标准的制定不合理,实际试验中无法操作,或主观条件偏大,易造成的误判。
4. 试验过程的质量控制:研究者未能严格遵循试验方案,在试验各环节缺少可行的质量控制措施,在动物入选、原始记录、参数检验等方面未能按照SOP执行,导致试验结果的规范性、可靠性存在问题。
六、兽药临床研究一般要花多长时间?
不同类型的兽药临床试验,试验周期不尽相同。一般在6-12个月。
七、目前可以开展兽药临床试验(具备GCP资质)的单位有哪些?

八、环健安评可提供哪些服务?
1. 对接临床试验单位,审核临床方案,跟踪临床试验进度;
2. 临床试验备案;
3. 试验计划/试验报告审核;
4. 与检测机构沟通,跟进整个试验流程;
5. 协助完成临床总结报告,整理新兽药注册材料。
联系方式
- 联系人:曹渭
- 电话:0757-28333064
- 邮箱:info@ehs.ac.cn
- 地址:广东省佛山市顺德区乐从镇佛山新城汾江南路235号依云国际财富中心2座103室



