
一、概述
根据《兽药管理条例》、《新兽药研制管理办法》和《兽药注册办法》,在开展兽药临床试验前须进行兽药非临床试验,新兽药研制单位须委托无隶属或其他利害关系的第三方兽药安全性评价单位开展新兽药非临床研究,以获得兽药注册以及临床研究所需的相关资料。
兽药非临床阶段主要是回答开发可行性问题,以决定是否投入资金进一步研发。此阶段一般用实验动物进行研究,包括药理学研究方面进行的药物的主要药效、一般药效、药代动力学和作用机理等研究,证明新兽药的有效性问题;毒理学研究方面包括急性毒性、长期毒性和特殊毒性研究,必要时还要进行毒代动力学研究,以证明安全性问题。另外,要根据药理学研究结果,开展有关的药学研究,评选并确定剂型,进行产品稳定性考察,制定相应的质量标准,并进一步开展原料药与制剂的中试生产,此阶段用试验动物进行试验。
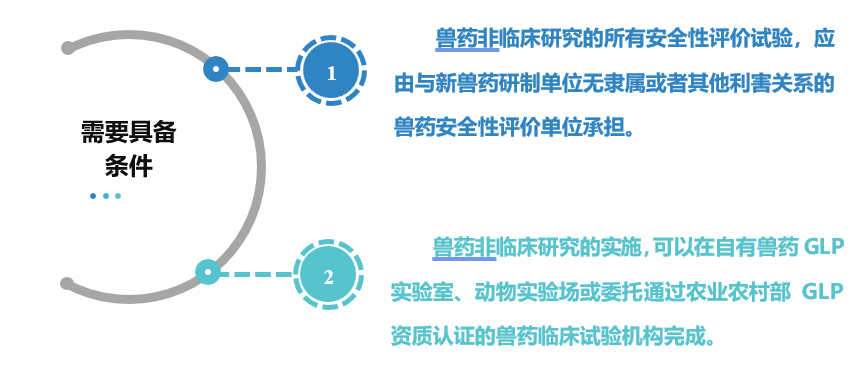
二、兽药非临床试验开展需要具备哪些条件?
三、兽药非临床试验开展有哪些基本流程?
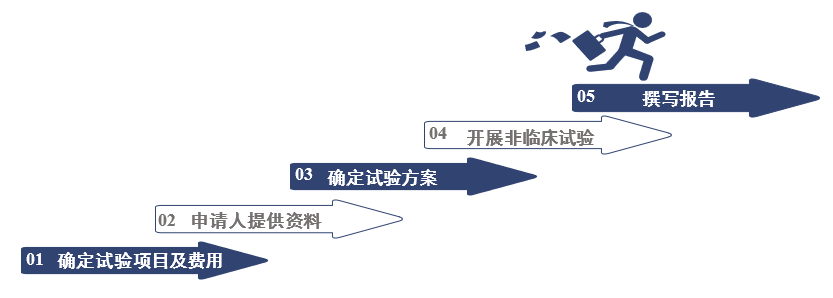
1. 申请人与试验机构沟通,确定试验项目、周期及费用。
2. 申请人提供非临床试验所需资料。
3. 申请人与试验机构沟通,共同确定试验方案。
4. 兽药临床试验机构开展临床试验、撰写报告。
四、兽用非临床研究涉及的试验有哪些?
新兽药临床前研究包括药学、药理学和毒理学研究,具体研究项目如下:

五、兽药安全性评价一般包括哪些内容?
1. 单剂量毒性试验
主要评价新兽药在单次给药情况下,通过不同途径接触后对生物体的毒性作用,包括全身毒性作用和局部毒性作用。按照给药途径分,需要进行以下的研究:
(1)急性毒性试验:指一日内对动物单次或多次给药,连续观察给药后动物产生的毒性反应及死亡情况的试验方法。经口(注射)一次性或24h内多次给予受试物后,在短时间内观察实验动物所产生的毒性反应,引起半数致死的剂量称为半数致死剂型, 通常LD50(半数致死量)表示。

(2)特殊给药途径的毒性评价
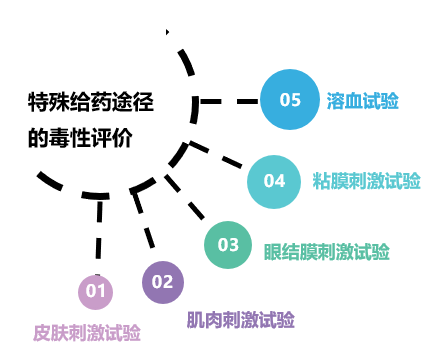
皮肤刺激试验:考察新兽药通过皮肤注射或透皮给药对局部皮肤产生的刺激反应,如红、肿、热、痛等,一般供注射和透皮吸收的制剂必须进行该试验。
肌肉刺激试验:考察新兽药通过肌内注射给药对局部肌肉产生的刺激性反应,一般供肌内注射的制剂必须进行该试验
眼结膜刺激试验:考察新兽药通过眼结膜给药对眼结膜产生的局部刺激性反应,进而了解对兽药生产者、使用者需进行的防护。一般眼科直接用药、喷雾和易挥发的制剂必须进行该试验。
粘膜刺激试验:考察新兽药通过阴道、子宫注入给药对阴道、子宫黏膜产生的局部刺激性反应,一般只有子宫注入剂必须进行该试验。
溶血试验:考察新兽药通过静脉注射给药后对血液细胞产生的毒性作用。一般静脉注射用制剂必须进行该试验,同时对此类制剂的溶媒有严格的选择规定。
2. 亚慢性毒性试验
当评价某受试药物的毒作用特点时,在了解受试药物的纯度、溶解特性、稳定性等理化性质和有关毒性的初步资料后,可进行30天或90天喂养试验,以提出较长期喂饲不同剂量的受试药物对动物引起有害效应的剂量、毒作用性质和靶器官,估计亚慢性摄入的危险性。90天喂养试验所确定的最大未观察到有害作用剂型可为慢性试验的剂型选择和观察指标提供依据。
考察新兽药多剂量给药情况下对实验动物的全身毒性作用,一般用大鼠经灌服途径给药,所有原料药必须进行该试验。
3. 致突变试验(Ames试验)
致突变试验(Ames试验)又称鼠伤寒沙门氏菌恢复突变试验,用于检测新兽药是否产生基因突变。据统计,该试验检出致基因突变化合物的符合率可达75%,甚至更高,如果药品具有致突变性,不能作为兽药使用,不得进行研发。
除此之外还要进行小鼠骨髓细胞微核试验、小鼠精子畸形试验或睾丸精原细胞染色体畸变分析试验、小鼠骨髓细胞染色体畸变分析试验及显性致死试验。需要注意的是原料药必做此阶段试验,各种制剂可不做。
4. 生殖毒性试验
生殖毒性试验是评价受试物对哺乳动物(啮齿类大鼠为首选)生殖的影响。与其他的药理学、毒理学研究资料综合比较,以推测受试物对人的生殖可能产生的毒性或危害性。

5. 慢性毒性试验(包括致癌试验)
慢性毒性试验目的是确定外来化合物药物的毒性下限,即长期接触该化合物可以引起机体危害的阈剂量和无作用剂量。为进行该化合物的危险性评价与制定动物接触该化合物的安全限量标准提供毒理学依据,如最高容许浓度和每日容许摄入量等。
六、目前可以开展兽药安全性评价(具备GLP资质)的单位有哪些?

七、环健安评可提供哪些服务?
1. 检测实验室的委托代理;
2. 试验计划/试验报告审核;
3. 与检测机构沟通,跟进整个试验流程。
联系方式
- 联系人:曹渭
- 电话:0757-28333064
- 邮箱:info@ehs.ac.cn
- 地址:广东省佛山市顺德区乐从镇佛山新城汾江南路235号依云国际财富中心2座103室
-
在线咨询
 点击图标
点击图标
专业客服 7x24H
为您服务 -
关注我们
 扫码关注公众号,获取更多企业信息
扫码关注公众号,获取更多企业信息
